Как создаются препараты для лечения рака
Кандидат химических наук и руководитель экспертного отдела Inbio Ventures Илья Ясный – о том, как были открыты одни из самых важных лекарственных препаратов последних лет в онкологии и как эти исследования поддерживали частные некоммерческие фонды.
Люди, далекие от медицины, часто спрашивают: «Когда уже будет изобретено лекарство от рака?» Я им отвечаю, что на нынешнем этапе развития науки лекарство «от рака вообще» изобрести невозможно, потому что рак – не одна болезнь. Известно более сотни его разновидностей, и мы находимся только в начале пути изучения этих заболеваний. И даже эта пройденная часть вдохновляет: некоторые виды рака уже научились лечить, а другие удается сдерживать так долго, что пациент живет не меньше средней продолжительности жизни. Но существует все ещё очень и очень много не поддающихся лечению онкологических заболеваний, лекарства для борьбы с которыми постоянно разрабатываются.
Немного статистики
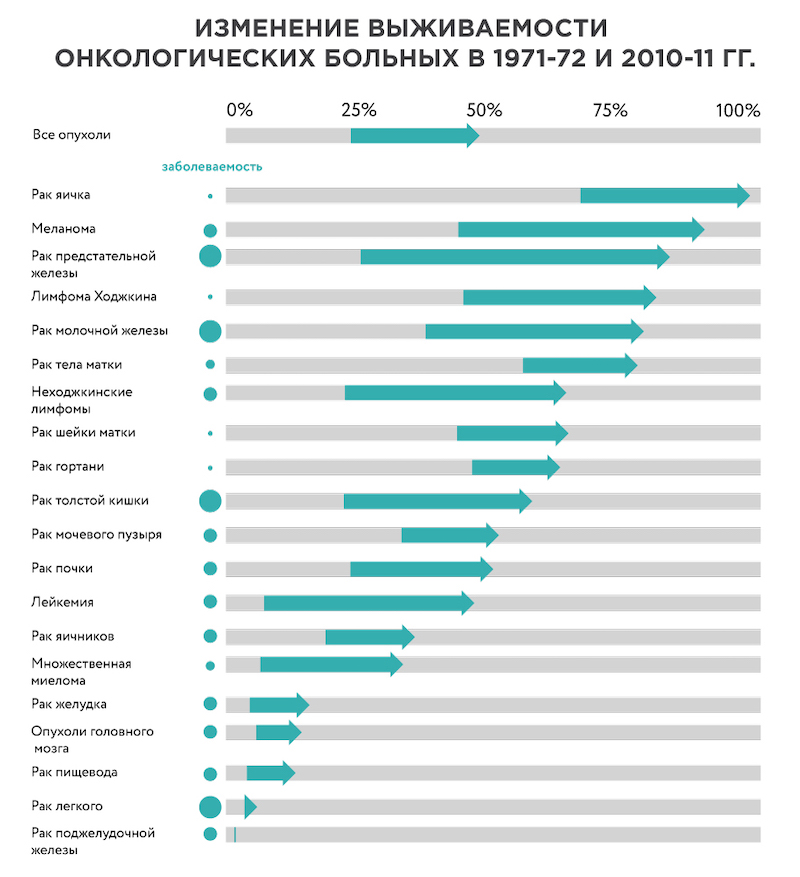
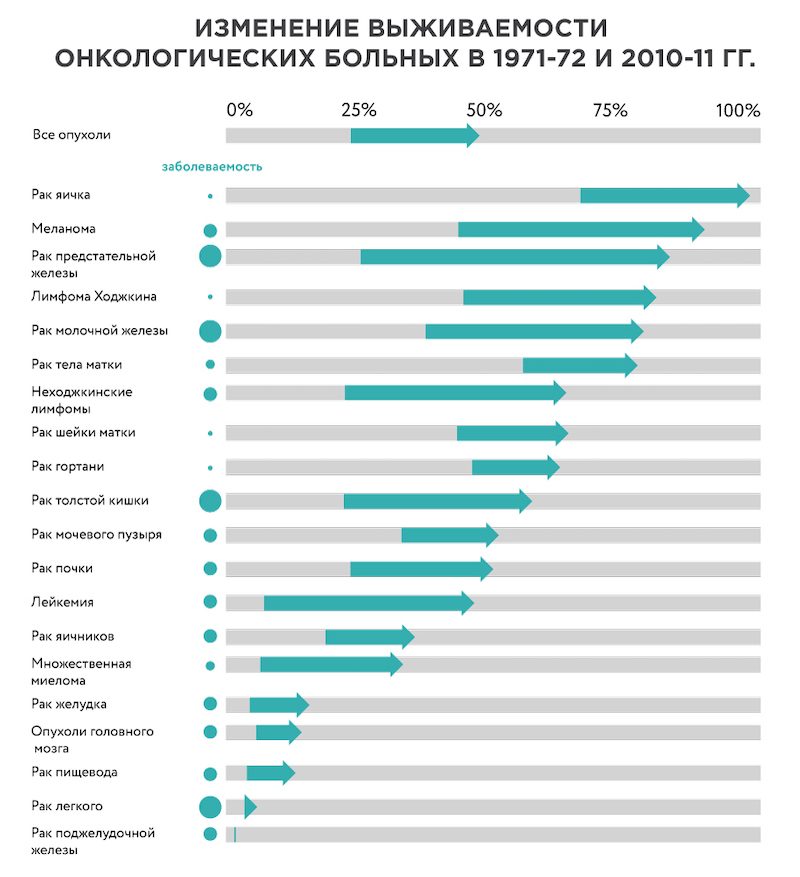
С 1970-х годов число онкологических больных, живущих более 10 лет после постановки диагноза, увеличилось вдвое. Особенные успехи достигнуты в лечении рака предстательной железы, некоторых видов лимфом, меланомы, рака молочной железы. C другой стороны, прогресс в лечении рака желудка, легкого и особенно поджелудочной железы пока невелик (Рисунок 1).
Рисунок 1. Увеличение 10-летней выживаемости при разных видах онкологических заболеваний в Великобритании с 1970-х по 2010-е годы. Источник картинки.
Почему возникает рак? Ответ на этот вопрос известен в общих чертах, но детали того, из-за чего у каждого конкретного человека возникла злокачественная опухоль, обычно неизвестны. В целом рак возникает тогда, когда какая-то клетка организма выходит из-под контроля и начинает неограниченно делиться, образуя опухоль. Такие клетки теряют свою специализацию и перестают реагировать на сигналы, которые бы заставили умереть здоровую клетку. Кроме того, они приобретают подвижность и способность метастазировать, то есть мигрировать в отдаленные участки организма и образовывать там новые опухоли.
В принципе, каждая делящаяся клетка организма может претерпеть злокачественное перерождение и дать начало онкологическому заболеванию. Как правило, это происходит в результате генетической мутации, которая может быть спонтанной или вызванной внешними причинами, например, облучением или вирусным заболеванием. Разовьется рак или нет в каждом конкретном случае – невозможно предсказать, так как исход зависит от множества факторов. К ним относятся и наследственность человека, и влияние среды, в которой он рос и живет, и состояние его организма, в частности, иммунной системы.
Даже в здоровом организме постоянно спонтанно возникают переродившиеся клетки, способные к неограниченному размножению. Но если у человека в порядке иммунная система, то она обеспечивает постоянный надзор за аномальными клетками и уничтожает их. Поэтому раковые клетки используют специальные ухищрения, чтобы защититься от иммунной системы организма. Опухоль выстраивает несколько линий обороны, и даже способна ставить себе на службу клетки иммунной системы, которые пришли ее убить.
Рак будет проявляться совершенно по-разному – в зависимости от того, какая именно клетка и в каком органе дала сбой. По малоизученным пока причинам некоторые из злокачественных опухолей растут гораздо быстрее, чем другие. Часть опухолей скорее дают метастазы, а главное – хуже подвергаются терапии. Ведь раковые клетки – в полном соответствии с законами эволюции – под воздействием лекарства либо умирают, либо мутируют и становятся неуязвимы для данных препаратов, и опухоль продолжает расти. Именно поэтому опухоль, которая уменьшилась под действием терапии, иногда снова начинает увеличиваться, и такие рецидивы (то есть повторное возникновение болезни) сложнее лечить.
В снижении смертности от онкологических заболеваний важную роль сыграли несколько факторов: это и улучшение методов хирургического лечения и радиотерапии, и появление новых лекарств, и профилактика, и развитие диагностики – многие опухоли лечатся лучше, если они обнаружены на ранней стадии.
Разработка лекарств от рака
В целом, создание лекарств – очень дорогое и длительное занятие, связанное с высоким риском провала. Разработка лекарственного кандидата начинается с поиска мишени – как правило, белка в организме, воздействие на который приведет к желаемому терапевтическому эффекту. Так, в случае рака это может быть белок, отвечающий за рост клеток. В идеале он должен присутствовать в злокачественных клетках и отсутствовать в здоровых. После того, как такая возможная мишень найдена, наступает этап проверки предположения, что воздействие на неё действительно приведёт к положительному эффекту и не вызовет нежелательных явлений.
Затем ученые ищут вещество, воздействующее на мишень, – сейчас, как правило, это либо перебор вариантов в химических «библиотеках», либо поиск биологической молекулы, которая будет избирательно связываться с мишенью. В настоящее время компьютерные методы позволяют проводить отбор перспективных молекул с помощью современных алгоритмов, после чего предсказания требуют подтверждения на практике.
Выбранную молекулу подвергают оптимизации для улучшения ее свойств, проверяя ее способность связываться с мишенью и вызывать нужные эффекты в клетках. Наконец выбранный кандидат в лекарство тестируют на животных, проверяя его эффективность в условиях модели заболевания и безопасность. Если препарат обладает достаточно хорошим соотношением безопасности и эффективности, он выходит в клинические исследования, то есть начинаются исследования с участием людей.
Как правило, препарат проходит три фазы клинических исследований, в которых принимают участие всё больше людей. На первой фазе тестируют безопасность препарата, на второй – подбирают дозу, режим введения и получают первые свидетельства эффективности. На третьей фазе проводят подтверждающие исследования эффективности. Если доказывается безопасность и эффективность препарата для лечения заболевания, его регистрируют и выпускают на рынок. В случае рака эффективными обычно считаются препараты, которые продлевают жизнь пациентов в среднем хотя бы на 10% по сравнению с существующей терапией.
Онкология относится к одной из самых рискованных областей разработки лекарств – только 5-8% препаратов, начинающих клинические исследования, доходят до регистрации. В среднем этот процесс занимает более 7 лет, и расходы составляют примерно 1,5 миллиарда долларов США. Понятно, что на ранней стадии исследований стартапу или научной группе, разрабатывающим новое лекарство, бывает трудно найти деньги на ключевые эксперименты, потому что с высокой вероятностью проект придется закрыть. Однако если никто не будет вкладываться в такие ранние рискованные исследования, то не будут появляться и новые лекарства. Один из способов, которым это противоречие решается в мире, – финансирование ранних разработок частными некоммерческими фондами, такими как российский РакФонд.
Примеры разработок
Вероятно, самый известный и крупный частный некоммерческий фонд в онкологии – Cancer Research UK (CRUK, Фонд исследований рака Великобритании). Он существует практически полностью на частные пожертвования и тратит на исследования рака более $500 млн в год. Благодаря поддержке Cancer Research UK до рынка дошел препарат абиратерон, который помогает миллионам пациентов, страдающим раком предстательной железы. Этот препарат предназначен для лечения метастатического рака предстательной железы: он ингибирует (то есть блокирует) производство гормона тестостерона, который стимулирует рост клеток этого рака.
Довольно давно было известно, что рост раковой опухоли простаты зависит от тестостерона, поэтому удаление яичек помогает его остановить, но ненадолго. Поскольку другие клетки в организме, например, клетки надпочечников, также производят тестостерон, которого хватает для стимуляции роста опухоли. Начались попытки найти молекулу, совсем выключающую синтез тестостерона.
В начале 1980-х годов ученые выяснили, что одна из стадий синтеза тестостерона в организме катализируется (то есть ускоряется) ферментом цитохром p450 17A1 (или CYP17). Ученые Института исследований рака в Сарри (Surrey), Великобритания, предположили, что известный противогрибковый препарат кетоконазол (он и сейчас продается в аптеках) – ингибитор CYP17 – может помочь и против рака предстательной железы. Оказалось, что он действительно задерживает рост опухоли, но действует не на всех пациентов, обладает побочными эффектами и очень быстро выводится из организма. Поэтому медицинские химики начали поиск аналогов кетоконазола, которые обладали бы его преимуществами, однако не имели бы таких недостатков.
В 1995 году вышла статья, в которой впервые была опубликована структура молекулы абиратерона, – самого сильного и при этом избирательного ингибитора CYP17 из всех полученных.
Потребовалось еще 16 лет исследований до его регистрации в 2011 году.
В конце 1990-х годов на средства Cancer Research UK было проведено первое клиническое исследование абиратерона, которое показало, что новый препарат действительно снижает уровень тестостерона в организме человека почти до нуля. Однако к тому моменту другие компании уже обнаружили, что комбинации некоторых известных препаратов также прекращают выработку тестостерона в яичках и других тканях организма, и начали использовать их для лечения рака предстательной железы. Предпосылок к тому, что абиратерон сможет повысить продолжительность жизни людей по сравнению с этим препаратами, не было, и никто не хотел рисковать и вкладывать в дальнейшую разработку абиратерона без знания его механизма действия и уверенности в том, что он будет эффективнее существующих лекарств.
Только к середине 2000-х появились данные о том, что клетки рака предстательной железы, лишаясь тестостерона от других тканей организма, начинают вырабатывать свой собственный! И тут вспомнили об абиратероне, который, в отличие от существующих препаратов, оказался способен прерывать синтез тестостерона и в раковых клетках. После ряда клинических исследований препарат был зарегистрирован сначала для пациентов, уже прошедших химиотерапию, а в 2016 году – и для тех, кто ее не получал, что обеспечило доступ к препарату для большого числа пациентов. Конечно, у препарата есть нежелательные явления, всё-таки он снижает уровень тестостерона почти до нуля, но польза от него значительно превосходит риск.
Важную роль в поддержке этой разработки сыграла финансовая и организационная помощь Cancer Research UK: все клинические исследования фазы 1 и 2 были выполнены на средства этой организации, и только самое большое и дорогое исследование фазы 3 – на деньги фармацевтического гиганта Johnson & Johnson. Пример абиратерона доказывает, насколько значимы лабораторные исследования для успеха препаратов в клинических исследованиях, и объясняет, почему РакФонд считает вложения в них столь важными.
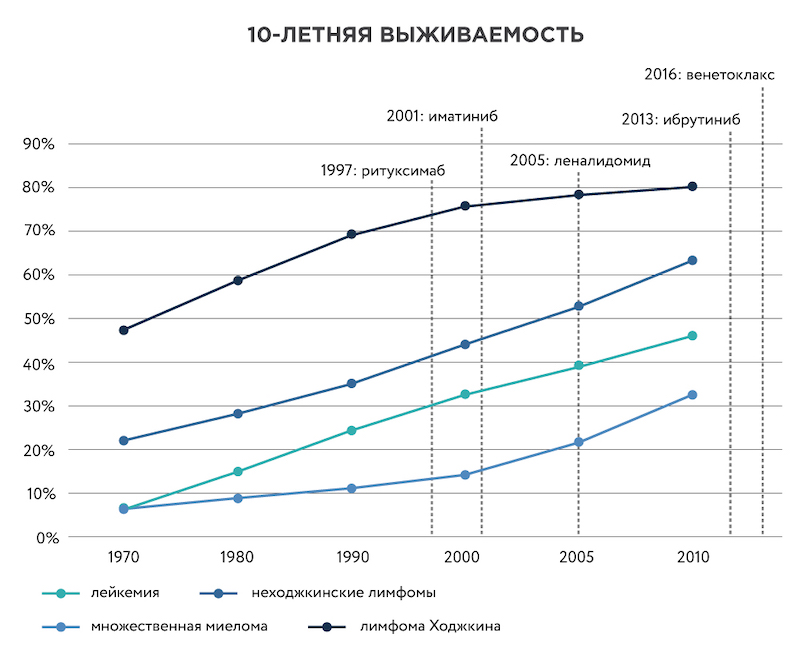
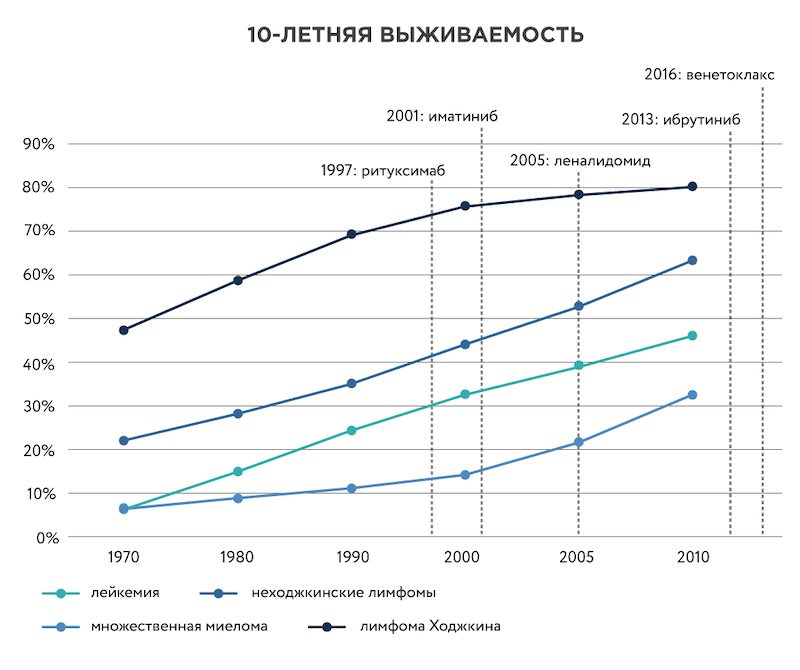
Другой пример частного некоммерческого фонда – Leukemia & Lymphoma Society (LLS) в США, вкладывающего средства в исследования в области онкогематологии. Из 21 препарата, зарегистрированного американским агентством FDA в 2018 году, фонд участвовал в разработке 19. Только в 2018 году LLS вложил в исследования $48 млн, а суммарно, начиная с 1949 года – более $1,2 млрд.
Рисунок 2. Рост 10-летней выживаемости при онкогематологических заболеваниях. Красными пунктирными линиями показан момент регистрации препаратов, созданных при участии Leukemia & Lymphoma Society. Данные по выживаемости с сайта Cancer Research UK.
Поддержка фонда сыграла важную роль в разработке таких лекарств, как иматиниб (торговое название препарата – Гливек), ритуксимаб (Мабтера), леналидомид (Ревлимид) и других. Благодаря этим препаратам диагноз лимфомы, миеломы и некоторых видов лейкемии, как правило, уже не считается приговором. У большинства пациентов детского возраста можно вылечить или длительно успешно контролировать эти злокачественные заболевания. В 2017 году были зарегистрированы первые препараты клеточной иммунотерапии острого лимфобластного лейкоза и лимфомы, получаемые с помощью генной инженерии – Kymriah и Yescarta. В их разработке LLS также принял непосредственное участие.
Однако исследования продолжаются, потому что у части детей и взрослых, особенно пожилых, не удается добиться ответа на терапию. Нужны более эффективные и безопасные лекарства.
Деятельность таких фондов, как Cancer Research UK, Leukemia & Lymphoma Society и РакФонда, направлена на финансирование ранних рискованных исследований лекарств и средств терапии. Не все из них докажут свою эффективность, однако именно эти усилия повышают вероятность, что еще одно лекарство от рака, которое сможет спасти жизни множества людей, будет разрботано.
Рисунки к статье: Анастасия Обухова