Потеря гетерозиготности в профиле коротких тандемных повторов (STR) опухолевой ДНК у пациентов c de novo диагностированным острым лимфобластным лейкозом как фактор неблагоприятного прогноза: промежуточные результаты исследования
Автор: Наталья Рисинская. Работа выполнена при поддержке Ракфонда, грант № 5/2019.
КЛЮЧЕВЫЕ СЛОВА: потеря гетерозиготности (LOH), de novo диагностированный ОЛЛ, хромосомные аберрации, скрытые хромосомные аномалии, однородительская дисомия
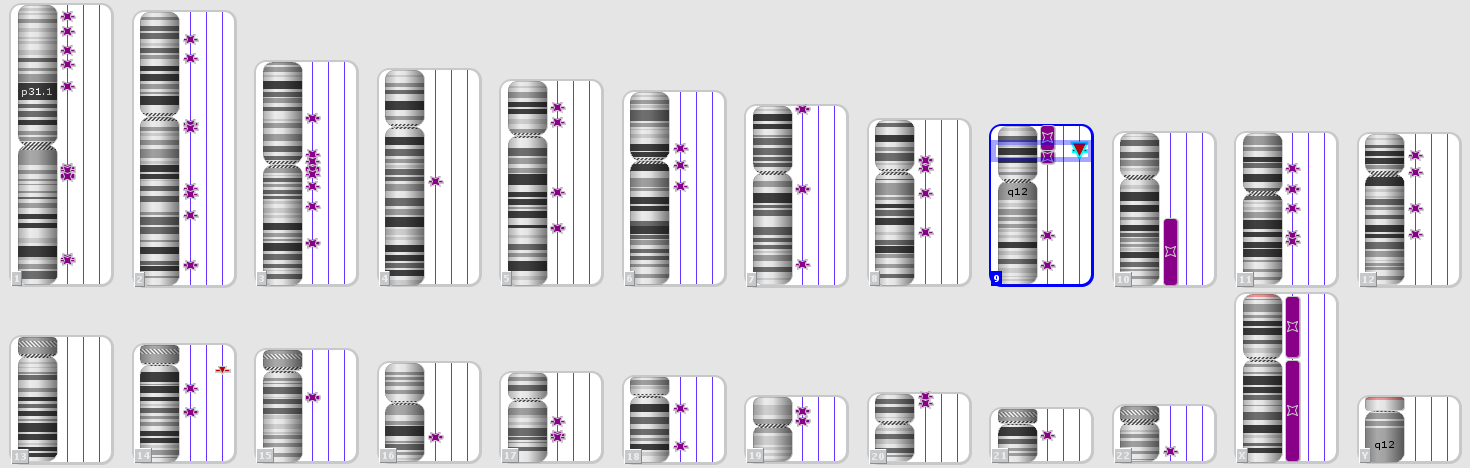
Введение. Острый лимфобластный лейкоз (ОЛЛ) представляет собой гетерогенную группу клональных заболеваний системы крови, при которых в лейкемические клетки трансформируются предшественники В-или Т-лимфоцитов. У взрослых больных ОЛЛ составляет менее трети от всех острых лейкозов, чаще всего заболевают молодые люди (медиана возраста составляет 30-35 лет). Для успеха терапии острых лимфобластных лейкозов важна максимально полная цитогенетическая и молекулярная характеристика опухоли. Генетическая нестабильность опухолевых клеток может приводить к изменению профиля коротких тандемных повторов (STR) опухоли относительно STR профиля здоровых клеток пациента (Рис.1).
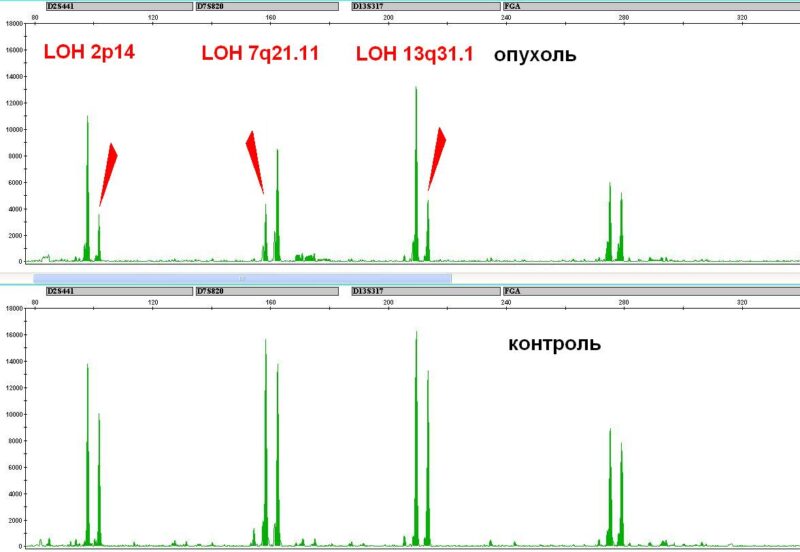
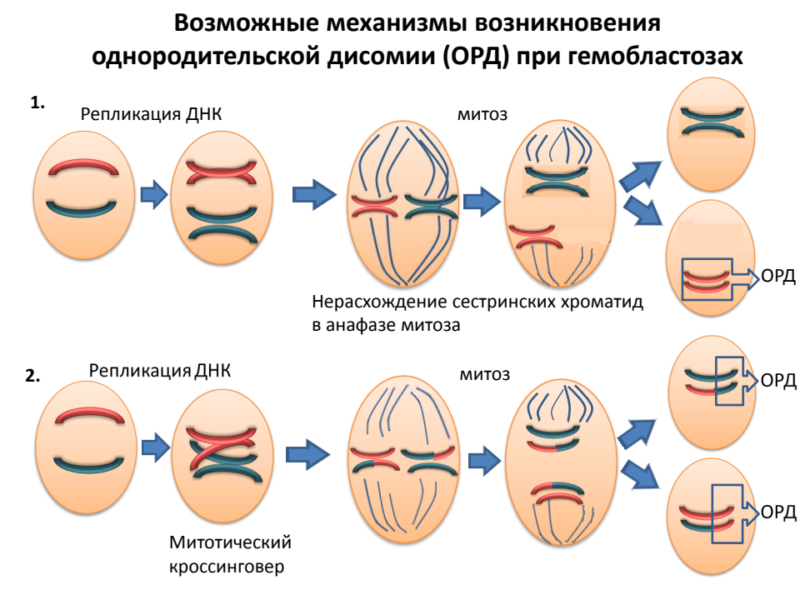
Потеря гетерозиготности или аллельный дисбаланс в STR локусах подтверждают выявленные стандартным цитогенетическим анализом хромосомые аберрации в содержащих данный STR локус хромосомах: делеции, моносомии, дупликации, появление изохромосом. Однако у некоторых пациентов потеря гетерозиготности наблюдается и при нормальном кариотипе опухоли. Причина — хромосомные аберрации, не выявляемые стандартным цитогенетическим анализом и методом FISH. Это однородительская дисомия (ОРД), или потеря гетерозиготности с сохранением числа копий ДНК. (Рис.2) Мы полагаем, что пациенты с такими хромосомными нарушениями должны относиться к группе высокого риска и получать соответствующую терапию.
Цель работы. Проанализировать связь потери гетерозиготности в бластных клетках пациентов с впервые диагностированным ОЛЛ с выявленными стандартным цитогенетическим анализом хромосомными аберрациями и верифицировать скрытые аномалии при расхождении данных цитогенетики и молекулярного анализа STR профиля опухоли. Оценить общую выживаемость пациентов в группе предполагаемого высокого риска относительно остальных пациентов.
Материалы и методы. Анализ STR-профилей ДНК опухолевых клеток был выполнен для 88 пациентов с de novo диагностированным Ph-негативным ОЛЛ, проходящих лечение по схеме «ОЛЛ-2016» в Национальном исследовательском центре гематологии (г. Москва, Россия), все пациенты относились к группе промежуточного риска согласно принятым клинико-диагностическим критериям. Возраст пациентов 18-55 лет, 53 мужчины и 35 женщин. ДНК была выделена из образцов костного мозга, взятых у пациентов при постановке диагноза. Контрольные образцы ДНК брали из крови пациентов в состоянии полной ремиссии и/или из буккального эпителия.
STR-профили для каждой пары образцов ДНК пациента (опухоль/контроль) получали методом мультиплексной ПЦР с использованием набора праймеров к 19 STR-локусам и локусу амелогенина человека COrDIS Plus (Гордиз, Москва) с последующим фрагментным анализом ПЦР-продуктов на генетическом анализаторе ABI 3130 (Thermofisher Scientific, USA). Хромосомный микроматричный анализ (ХМА) ДНК с выявленной потерей гетерозиготности в STR-локусах был выполнен на базе лаборатории молекулярной патологии «Геномед» с использованием системы Геноскан 3000.
Результаты. Нормальный цитогенетический кариотип опухоли был установлен для 37 пациентов, аномальный кариотип — для 51 пациента. Анализируя STR-профили ДНК из опухолевых и здоровых клеток каждого пациента, мы наблюдали потерю сигнала от одного из пары аллелей в гетерозиготных STR-локусах у двадцати пациентов (23%). У семерых из них был установлен нормальный кариотип опухоли. Кроме того, и при аномальном кариотипе STR локусы с потерей гетерозиготости не всегда принадлежали аберрантным хромосомам. Методом хромосомного микроматричного анализа было выявлено наличие однородительской дисомии плеча или всей хромосомы, нормальной по данным цитогенетического анализа, но несущей STR-локус с потерей гетерозиготности.
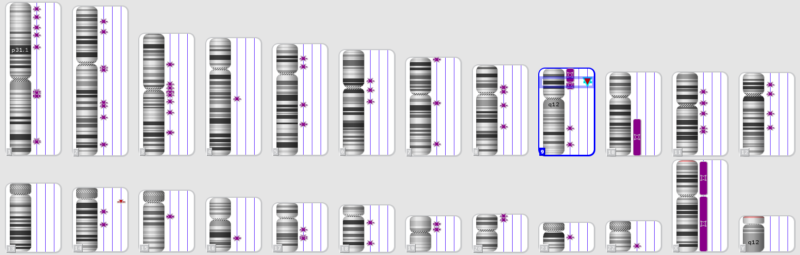
Так, у одного пациента с нормальным кариотипом в область однородительской дисомии 9p(24.3-13.3) попала микроделеция 9p21.3(21656682_22304230)x0, в результате кластер генов MTAP,CDKN2A-AS1,CDKN2A,CDKN2B-AS1,CDKN2B, содержащий три гена-онкосупрессора, продукты которых участвуют в регуляции антипролиферативной и проапоптотической активности Rb1 и p53, вообще не представлен в геноме опухоли (Рис 3).
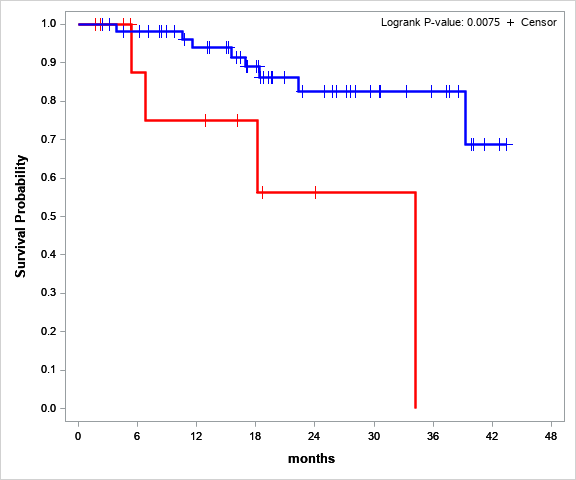
Пациент погиб от прогрессии заболевания в результате резистентости к терапии. Предварительные результаты анализа общей выживаемости показали, что наличие потери гетерозиготности является значимым фактором неблагоприятного прогноза. В группе с потерей гетерозиготности вероятность неблагоприятного события (смерти) в 4.11 (ci95 1.08-15.63) раза выше (Рис.4).
Кроме того, при анализе клинико-лабораторных показателей у пациентов в дебюте заболевания было выявлено, что в группе риска уровень тромбоцитов у пациентов статистически значимо ниже, чем в контрольной группе. Объяснения этому факту у нас пока нет.
Заключение. Анализ STR-профиля опухоли подтверждает и дополняет данные цитогенетического анализа, а также выявляет аномальный кариотип в случае отсутствия митозов в клетках образца. Кроме того, ПГ при нормальном кариотипе опухоли выявляет феномен однородительской дисомии, часто являющийся причиной перехода онкогенных соматических мутаций в гомозиготную форму. Согласно нашим данным, выявленная потеря гетерозиготности даже при нормальном кариотипе опухолевых клеток значимо отягощает прогноз заболевания.
Резюме
Выявление потери гетерозиготности (ПГ) в опухолевой ДНК пациентов не входит в стандартный набор молекулярных исследований, а в основном обнаруживается случайно при мониторинге химеризма (соотношения генетически различных клеток донора и реципиента) с помощью анализа STR-локусов у пациентов после трансплантации костного мозга при рецидиве (повторном возникновении) заболевания.
Нам было важно провести специальное исследование на большой выборке пациентов в дебюте заболевания с общим диагнозом и протоколом лечения, чтобы доказать, что потеря гетерозиготности в STR-локусах отражает серьезные скрытые хромосомные события и влияет на исход заболевания. Благодаря поддержке Ракфонда мы смогли верифицировать эти аберрации методом хромосомного микроматричного анализа и убедились в том, что у всех пациентов с выявленной потерей гетерозиготности в геноме опухолевых клеток произошли дополнительные масштабные изменения как при нормальном цитогенетическом кариотипе, так и при аномальном в дополнение к выявленным стандартным цитогенетическим анализом и FISH.
Оценив общую и бессобытийную выживаемость пациентов, мы убедились в том, что потеря гетерозиготности, выявленная при STR-профилировании опухолевой ДНК относительно ДНК из нормальных клеток пациента, является независимым фактором плохого прогноза. STR-профилирование — доступный и простой метод интегральной оценки изменений генома опухоли. Мы надеемся, что по итогам нашего исследования этот метод будет постепенно введен в рутинную практику молекулярных исследований при острых лейкозах в дополнение к стандартной цитогенетике или даже как основной метод при оценке ДНК из архивных материалов (например, архивных стекол c мазками костного мозга), когда цитогенетический анализ просто невозможен.
Кроме несомненной практической значимости полученных результатов эта работа ценна еще и тем, что мы смогли расширить наши представления о природе малигнизации клетки и о вкладе в этот процесс однородительской дисомии.
В настоящий момент мы исследовали весь доступный материал от пациентов, получающих лечение в соответствии с рандомизированным протоколом «ALL-2016» в Национальном медицинском исследовательском центре гематологии (г. Москва, Россия) и смогли сделать вывод о статистической значимости потери гетерозиготности как фактора плохого прогноза.
Нам предстоит сопоставить данные хромосомного микроматричного анализа, STR-профилирования и стандартного цитогенетического анализа, чтобы определить спектр хромосомных аберраций, возможных при потере гетерозиготности в каждом STR-маркере панели Cordis+.
Кроме того, мы планируем продолжить работу и после окончания гранта, расширить исследуемую когорту пациентов, чтобы выявить STR-маркеры, потеря гетерозиготности в которых наиболее драматически влияет на исход заболевания.