Результаты поддержанного РакФондом исследования Рисинской Н.В.
Потеря гетерозиготности в локусах коротких тандемных повторов (STR), обнаруженная в ДНК опухолей у пациентов с ОЛЛ, как фактор неблагоприятного прогноза
Национальный исследовательский центр гематологии, Москва, Российская Федерация (Россия)
Генетическая нестабильность опухолевых клеток может приводить к изменению профиля коротких тандемных повторов (STR) опухоли по отношению к STR-профилю здоровых клеток пациента. Потеря гетерозиготности или аллельный дисбаланс в STR-локусах подтверждают хромосомные аберрации, выявленные стандартным цитогенетическим анализом в хромосомах, содержащих этот STR-локус: делеции, моносомии, дупликации и появление изохромосом. Однако у некоторых пациентов потеря гетерозиготности (ПГ) наблюдается и при нормальном кариотипе опухоли (потеря гетерозиготности с сохранением копийности ДНК или однородительская дисомия).
Нашей целью было оценить корреляцию между потерей гетерозиготности в бластных клетках пациентов с диагнозом ОЛЛ de novo и хромосомными аберрациями, выявленными стандартным цитогенетическим анализом, а также проверить скрытые аномалии в случае расхождений между цитогенетическими данными и молекулярным анализом STR профиля опухоли.
Из-за некоторых ограничений, вызванных карантином COVID, график контрольных точек был незначительно задержан.
Исследование когорты пациентов с ОЛЛ на предмет потери гетерозиготности в STR-маркерах было проведено в два периода: май-июнь и август-сентябрь 2020 года. Хромосомный микроматричный анализ (ХМА) был проведен в сентябре-октябре 2020 года.
Результаты ХМА, выявившие границы участков потери гетерозиготности, а также гены, вовлеченные в область однопародительской дисомии, делеций и дупликаций, были проанализированы, а статистическая оценка влияния потери гетерозиготности на общую и бессобытийную выживаемость пациентов была проведена в сентябре-октябре 2020 года. Были протестированы образцы 88 пациентов с de novo диагностированным Ph-негативным ОЛЛ, проходящих курс лечения по протоколу ОЛЛ-2016 в ФГБУ «НМИЦ гематологии Минздрава России» (Москва, Россия).
Пациенты были в возрасте 18-55 лет, 53 мужчин и 35 женщин. ДНК была выделена из образцов костного мозга, взятых у пациентов при постановке диагноза. Контрольные образцы ДНК брали из крови пациентов в полной ремиссии и / или из буккального эпителия. STR-профили для каждой пары опухоль / контрольный образец получали с помощью мультиплексной ПЦР с использованием набора COrDIS Plus (Гордиз, Москва) с последующим фрагментарным анализом продуктов ПЦР на генетическом анализаторе ABI 3130 (Thermofisher Scientific, США). Хромосомный микроматричный анализ (ХМА) ДНК с обнаруженной потерей гетерозиготности в STR-локусах был выполнен в лаборатории молекулярной патологии Геномед (Москва, Россия) с использованием системы Genoscan 3000.
Полученные результаты
Нормальный цитогенетический кариотип опухоли установлен у 37 пациентов, аномальный кариотип выявлен в 51 случае. При анализе STR-профилей ДНК из опухолевых и здоровых клеток каждого пациента мы обнаружили потерю сигнала от одного из пары аллелей в гетерозиготных STR-локусах у 21 пациента (24%). У семи из них был нормальный кариотип опухоли. Также в случае аномального цитогенетического кариотипа локусы с потерей гетерозиготности не всегда принадлежали аберрантным хромосомам.
Из 14 человек с аномальным кариотипом опухоли у 8 анализ STR-профиля выявил аллельный дисбаланс в локусах, в котором методом ХМА были подтверждены дополнительные хромосомные аберрации, не обнаруженные цитогенетическим анализом. А у 6 человек потеря гетерозиготности в STR-локусах, подтвержденная ХМА, совпала с данными цитогенетического анализа. Таким образом, анализ STR-профилей выявил дополнительные нарушения у 15 из 88 человек (17%). У этих 15 пациентов с ХМА были обнаружены аберрации, включающие до 190 миллионов пар оснований (более 1000 генов). У большинства пациентов с изменениями STR-профиля на ХМА были обнаружены дополнительные хромосомные аномалии, которые не были идентифицированы цитогенетическим анализом и анализом STR-профиля.
Одной из этих аномалий была однородительская дисомия плеча или всей хромосомы, цитогенетически нормальной, но при этом несущей STR-маркер с потерей гетерозиготности. Мы сопоставили частоту ПГ в STR-маркерах и характер хромосомных аберраций, обнаруженных ХМА. Одной из часто встречающихся была ПГ маркера D12S391 (локализация 12p13.2) — около 38% (у 8 из 21 пациента). Хромосомный микроматричный анализ показал, что при ПГ 12p на коротком плече 12й хромосомы в геноме опухоли наблюдалась делеция в 25%, дупликация в 6% и однородительская дисомия в 6%. Пациенты с ПГ на коротком плече хромосомы 12 (12p) могут быть исключены из группы риска, поскольку, согласно некоторым публикациям, ПГ12p не связана с худшим исходом [Takeuchi et al Leukemia 2003, Kawashima-Goto et al Int J Hematol. 2015]
Однако, наиболее часто в группе больных ОЛЛ встречалась ПГ на коротком плече 9-й хромосомы. ХМА верифицировал эту аберрацию как делецию у 38% (8 из 21 пациента) и однородительскую дисомию у 19% (4 из 21 пациента). * Клинический случай: у одного пациента с нормальным кариотипом и потерей гетерозиготности в STR-профиле хромосомный микроматричный анализ показал микроделецию на 9p21.3 (21656682_22304230), входящую в область однородительской дисомии на 9p (24,3-13,3). В результате комбинации двух этих хромосомных аберраций, ведущих к гомозиготной форме делеции, из генома опухоли полностью выпадает кластер генов MTAP, CDKN2A-AS1, CDKN2A, CDKN2B-AS1, CDKN2B, содержащих три гена онкосупрессоров, участвующих в регуляции антипролиферативной и проапоптотической активности Rb1 и p53. Пациент умер от прогрессии заболевания. ПГ 9p кажется наиболее неблагоприятным молекулярным маркером в панели исследуемых STR-локусов из-за набора генов, находящихся на коротком плече 9-й хромосомы, однако в наблюдаемой нами когорте ПГ 9p встречается в сочетании с другими маркерами с ПГ, что затрудняет оценку ПГ 9p как независимого фактора риска.
Статистический анализ
По нашему мнению, ПГ является вероятным независимым фактором риска худшей общей и безрецидивной выживаемости у пациентов с ОЛЛ. Нулевая гипотеза — потеря гетерозиготности не связана с худшей безрецидивной и общей выживаемостью (БРВ и ОВ). Для оценки независимого воздействия нового фактора риска на фоне других стандартных факторов для этой группы пациентов был использован анализ общей и безрецидивной выживаемости. Исходя из предварительно полученных данных, мы ожидали, что группа риска по критериям потери гетерозиготности составит 15-20% от всей когорты. Но в нашем проекте группа пациентов с ПГ составила 24% (21 пациент из 88). Анализ ОВ и БРВ показал, что ПГ представляет собой значительный фактор риска для неблагоприятного прогноза (коэффициент риска = 4,1 (ci95 1,1-15,6)) (Рис.1)
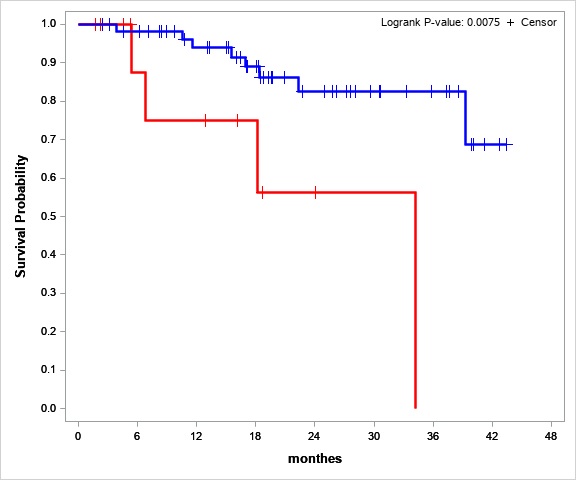
Рис.№1 Общая оценка выживаемости пациентов со стабильным STR-профилем (синяя линия) и LOH (красная линия)
Мы также попытались оценить ПГ 12p как отдельный фактор риска. Общая выживаемость в группе LOH 12p составила 100%. ПГ 12p кажется маркером благоприятного прогноза, но группа пациентов с ПГ 12p без каких-либо других вариантов ПГ слишком мала (три человека) для оценки статистической значимости.
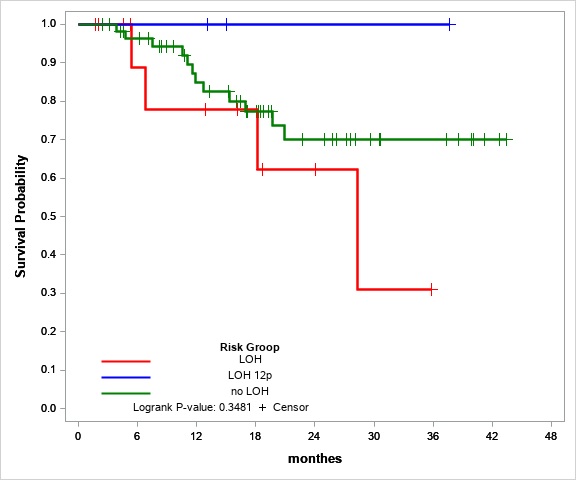
Рис. №2 Общая оценка выживаемости для пациентов со стабильным STR-профилем (зеленая линия), LOH (красная линия) и LOH 12p (синяя линия)
Вывод
Анализ STR-профиля в опухолевых клетках подтверждает и дополняет данные цитогенетического анализа, а также выявляет аномальный кариотип при отсутствии митозов в образце. Более того, выявление ПГ при нормальном кариотипе опухоли выявляет феномен однородительской дисомии, скрытой хромосомной аберрации, которая часто является причиной перехода онкогенных мутаций в гомозиготную форму, что ухудшает прогноз заболевания. Изучение ПГ 12p как благоприятного и ПГ 9p как худшего прогностического фактора требует исследования на расширенной выборке пациентов.
Результаты были представлены на ежегодном конгрессе Общества онкогематологов 2020 9-12 сентября 2020 г. (стендовый доклад), подготовлены к III Конгрессу гематологов России (отменен), представлены на XIV симпозиуме памяти Раисы Горбачевой «Трансплантация гемопоэтических стволовых клеток. Генная и клеточная терапия» и на XXVII Международной научной конференции студентов, аспирантов и молодых ученых «Ломоносов» 10 — 27 ноября 2020 г. (стендовый и устный доклады).

